Ingrediente revigorado: Esqualano de alta qualidade, renovável, proveniente de cana de açúcar sustentável

Tecnologia de ponta revigora o melhor emoliente de sua classe: Esqualano de alta qualidade, renovável, proveniente de fonte sustentável e feito a partir da cana de açúcar brasileira.
Derek McPhee 1,*, Armelle Pin 1, Lance Kizer 1, Loren Perelman 1 and Joao Paulo Passador Rossi 2
- Autor cujas correspondências devem ser encaminhadas: [email protected] (+1 510 740 7418)
Qualificação dos Autores: Derek McPhee, Ph.D., Diretor Sênior de Tecnologia Estratégica. Armelle Pin, M.Sc. ([email protected]), Diretora Associada, Gestão de Produtos
Lance Kizer, Ph.D. ([email protected]), Cientista Sênior, Líder Técnico para Cosméticos. Loren Perelman, Ph.D. ([email protected]), Cientista Sênior, Química Analítica.
Joao Paulo Passador Rossi, Engenheiro ([email protected]), Coordenador Comercial.
Endereços: 1 Amyris Inc. 5885 Hollis St, Suite 100, Emeryville, CA 94608, USA
2 Amyris Brasil. Rua John Dalton, 301, Bloco B Ed 3, Techno Park, Campinas-SP, 13069-330
Abstrato em Português
O Esqualano é um dos emolientes de mais alta qualidade disponível no mercado, devido as suas excepcionais propriedades hidratantes e ao seu sensorial único, que combinada com suas características técnicas, o torna um ingrediente cosmético altamente valorizado pelos formuladores. Infelizmente, seu uso sempre esteve limitado pela incerteza no seu fornecimento e consequentemente, a volatilidade no seu preço. Este artigo descreve um processo produtivo inovador, que com base em uma plataforma de biotecnologia, passa a oferecer ao mercado acesso a este produto sem limitações no fornecimento ou problemas de qualidade e a partir de uma fonte renovável: a cana de açúcar.
Abstracto en Español
El Escualano es uno de los emolientes de más alta calidad presente en el mercado, debido a sus excepcionales propiedades humectantes y tacto único, combinado con excelentes propiedades técnicas, que lo hacen un ingrediente cosmético muy apreciado por los formuladores de cosméticos.
Desafortunadamente, su uso siempre ha estado limitado por su incierta disponibilidad y la consiguiente volatilidad en su precio. Este artículo describe un nuevo proceso de fabricación basado en la biotecnología que permite la oferta de este producto al mercado sin limitaciones o problemas de calidad partiendo de un material renovable y sustentable, la caña de azúcar.
English Abstract
Squalane is one of the highest quality emollients available due to its exceptional moisturizing properties and unique feel, combined with excellent technical properties, which make it a highly valued cosmetic ingredient. Unfortunately, its use has always been constrained by supply uncertainty and the resulting price volatility. This article describes how a novel biotechnology-based manufacturing process now
provides access to this product from sugarcane, a renewable resource, making this material available to the market without supply limitations or quality issues.
Introdução
Esqualano (nome INCI: Esqualano , Figura 1a) é um nobre ingrediente cosmético, devido as suas excelentes propriedades. Na sua forma pura, é um hidrocarboneto líquido incolor, quase inodoro e insípido, com alta estabilidade física e química. Trata-se de um dos emolientes de mais alta qualidade disponível no mercado, devido ao perfil sensorial, a biocompatibilidade com a pele e a composição consistente. O esqualano ocorre naturalmente em pequenas quantidades nas camadas lipídicas da pele, assim como o seu precursor: o esqualeno [1], e sua função é evitar a perda de hidratação e restaurar a elasticidade e flexibilidade da pele. Suas excepcionais propriedades hidratantes e sua capacidade de penetração na pele faz do esqualano um ingrediente cosmético altamente valorizado pelos formuladores. O esqualano é altamente hidratante e de rápida absorção, proporcionando um toque suave e luxuoso, sem deixar um aspecto oleoso na pele após a utilização. Do ponto de vista técnico, é facilmente emulsionado, possui excelentes propriedades de dispersão e compatibilidade com outros ingredientes cosméticos. É solúvel em todos os meios de cosméticos e pode ser usado sem limites de concentração em todos os tipos de formulações, incluindo skincare, bodycare, haircare, e produtos de maquiagem. Por ser um produto livre de impurezas, o esqualano é não- tóxico e não- irritante [2] .
Figura 1: Estruturas químicas do esqualano e do esqualeno.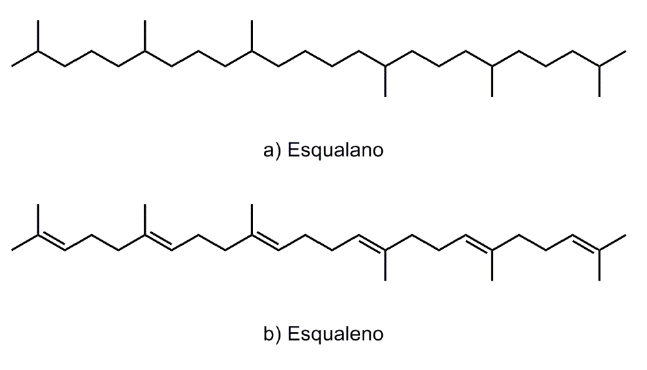
Fontes Tradicionais de Esqualano
Esqualano é tipicamente produzido por hidrogenação catalítica de esqualeno (Figura 1b), um hidrocarboneto triterpênico natural, sendo um dos lipídeos mais importantes das células da pele humana. É sintetizado em glândulas sebáceas, e representa até 13% do total de lipídios [3]. A sua concentração na pele varia de acordo com o local da pele [4], e a secreção de esqualeno, varia de indivíduo para indivíduo, mas está na faixa de 125-475 mg por dia [5 . Também é encontrado em plantas [6], procariotas , leveduras e microalgas [7]. Em escala comercial, o esqualeno tem sido tradicionalmente obtido a partir de óleo de fígado de tubarão e tem uma longa história de uso na China, Japão e Coréia. O óleo de fígado de tubarão foi mencionado pela primeira vez na imprensa em um compêndio chinês de remédios tradicionais em meados do século 16. No início do século 20 um hidrocarboneto altamente insaturado foi isolado independentemente do óleo de fígado de tubarão pelos Srs. H. Marcelet , AC Chapman e M. Tsujimoto [8] , que identificaram sua fórmula como C30H50 e nomeando-o como ” esqualeno ” , fazendo alusão ao fato de os tubarões pertencerem à família Squalidae [9] . Devido a suas múltiplas ligações duplas, o esqualeno foi considerado muito instável para muitos usos práticos até 1950, até que o Sr. Sebastien Sabetay da empresa francesa Laserson e Sabetay teve a ideia de fazer a hidrogenação deste composto, resultando na obtenção do esqualano (ou perhydrosqualane como era então conhecido) [11] . Esta ação permitiu que o produto passasse a ser comercializado como um importante ingrediente cosmético [12] .
No final dos anos 70, a empresa japonesa Kuraray produziu pela primeira vez o esqualano totalmente sintético. Apesar de seu elevado grau de pureza, o alto custo deste material (devido aos múltiplos passos de síntese química) limitou a sua utilização em produtos de consumo de massa.
Conhecido de longa data, o esqualeno, também é encontrado em pequenas quantidades em uma variedade de óleos vegetais, incluindo o azeite de oliva (0,2-0,5%) [14], óleo de palma (0,8% no destilado de ácido graxo (PFAD) e 0,06-0,1% em seu óleo bruto) [15], óleo de semente de amaranto (6-8%) [16] entre outros [17]. Embora a quantidade de esqualeno em azeite de oliva seja tipicamente inferior a 0,5%, ela se encontra concentrada na fração não saponificável do óleo (60-75%) [18]. Porém, sua recuperação direta era economicamente inviável até 1980, quando várias empresas espanholas patentearam, de forma independente, métodos para extrair e purificar esqualeno a partir desses resíduos do processamento de azeite de oliva [19]. Finalmente, a empresa Hispano Quimica SA (adquirida em 2000 pela Cognis que por sua vez foi comprada pela BASF em 2010) foi pioneira na comercialização do “Plant Squalane” (ou Phytosqualane), sintetizado a partir de esqualeno obtido do destilado de azeite de oliva desodorizado (OODD), um resíduo concentrado, proveniente da última etapa do processo de refino do azeite, contendo até 30% de esqualeno.
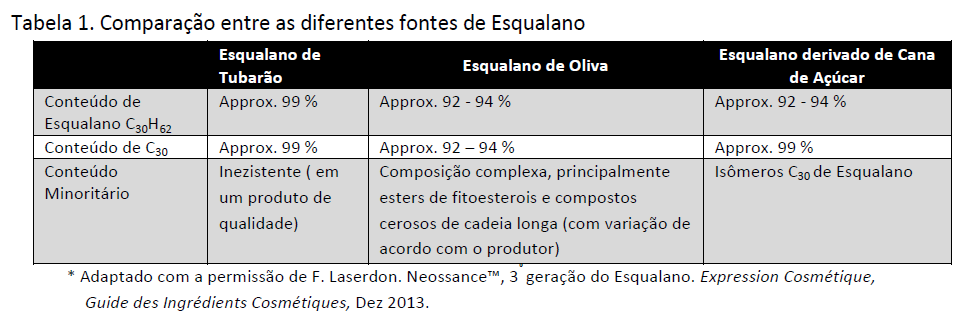
Apesar de todos os esqualanos 100% puros serem idênticos, mesmo provenientes de diferentes fontes, o que se vê na prática, é que todos os materiais comercialmente disponíveis apresentam diferenças em relação às impurezas, que são trazidas das diferentes matérias-primas de origem. Por exemplo, o esqualeno de fonte de tubarão pode conter vários poluentes ambientais (PCBs, dioxinas, metais pesados) que são bioacumulados no fígado do animal [20]. Ele também contém impurezas decorrentes do processo de biossintese (triacil gliceróis de baixa volatilidade e éteres de gliceril e até 0,1 % de hidrocarboneto pristano C19, que é um severo irritante). O esqualeno obtido a partir de resíduos de fabricação do azeite é tipicamente contaminado com os subprodutos do processo, como ceras de diferentes plantas, ácidos graxos livres, fitoesteróis e subprodutos oriundos da neutralização de odores. Todas estas impurezas fazem com que seja extremamente importante a adição de etapas complementares de purificação, visando à segurança desses materiais para utilização em produtos cosméticos. Maiores detalhes das diferenças entre o Esqualano de fontes animais e vegetais (Phytosqualane) podem ser encontrados em uma revisão feita por Gasparoli et al [21] . A Tabela 1 resume a composição dos esqualanos de diferentes fontes.
Tabela 1. Comparação entre as diferentes fontes de Esqualano
O fornecimento de Esqualano sempre esteve sujeito a incertezas de safra, seja associada à produtividade da indústria de azeite de oliva ou da pesca de tubarão em alto mar. Para complicar ainda mais a situação da oferta desse produto, desde meados da década de 2000, esqualano tem sido o foco de uma série de campanhas da sociedade contra a prática da pesca de espécies ameaçadas de tubarões para produção de ingredientes cosméticos [22]. A partir de 2005, uma campanha liderada pela instituição Oceana, levou uma série de grandes empresas da área de cosméticos a se comprometerem publicamente em interromper o uso de esqualano de fonte de tubarão em seus produtos [23]. Além disso, campanhas periódicas de “reciclagem” tem sido constantemente publicadas para manter a pressão sobre empresas de cosméticos [24], inclusive com artigos recentes, como o da Fundação da Justiça Ambiental (“Environmental Justice Foundation”) feito no final de 2013 [25], com foco no “mercado negro” de esqualano de tubarão, comercializado ilegalmente puro ou misturado ao esqualano derivado de azeite de oliva, mesmo existindo testes analíticos que detectam a fonte do produto [26], e obviamente que o artigo pressionava por exigências de rotulagem de produtos que identifiquem claramente aqueles que contem esqualano de tubarão.
Biotecnologia em Ação
Mesmo diante das diversas incertezas em relação ao esqualano, tais como restrição de oferta, volatilidade dos preços e pressões sociais, e ainda sendo um material somado com propriedade sensorial única, a biotecnologia só foi capaz de oferecer uma solução que atendesse todas as preocupações em torno deste produto no início desse século, proporcionando uma solução com um elevado grau de pureza, estável, capaz de ser produzido em escala industrial e com baixo custo, a partir de fonte renovável e sem precisar sacrificar os tubarões ou utilizar resíduos da indústria da oliva de oferta volátil. A existência do esqualeno na rota dos isoprenoides para produção de esteroides já era conhecida desde 1920 [27], mas foi somente após o trabalho de Konrad Bloch, com sua a elucidação a respeito da biossíntese de colesterol, e que levou o autor ao Premio Nobel (1964), que essa rota foi comprovada [28]. Com isso, foi apenas uma questão de tempo até os cientistas aproveitarem o poder da biologia para a produção de esqualeno, e consequentemente, esqualano. Porém, a falta de mecanismos adequados para manipular material genético fez com que isso só fosse possível em meados dos anos 1990, quando os cientistas da Mycogen Corporate modificaram os genes da levedura oleaginosa Yarrowia Lipolítica para produzir Esqualeno, com o intuito de produzi-lo em uma escala comercial através de fermentação com esse microrganismo programado. Embora a Mycogen tenha sido capaz de elevar substancialmente a produtividade em até 2% – base seca celular (CDW), em relação ao nível natural de 0,45%, eles não conseguiram cumprir as metas do projeto (15% de rendimento cdw a um custo de US$ 22/lb), e o projeto foi encerrado em 1998, após a aquisição da Mycogen pela Dow AgroScience [29]. As tentativas posteriores para melhorar esses resultados foram principalmente confinadas a laboratórios acadêmicos [30], embora um levantamento da literatura de patentes recente revela o interesse contínuo de algumas das grandes empresas químicas nesta área [31].
Uma solução “Made in Brasil”
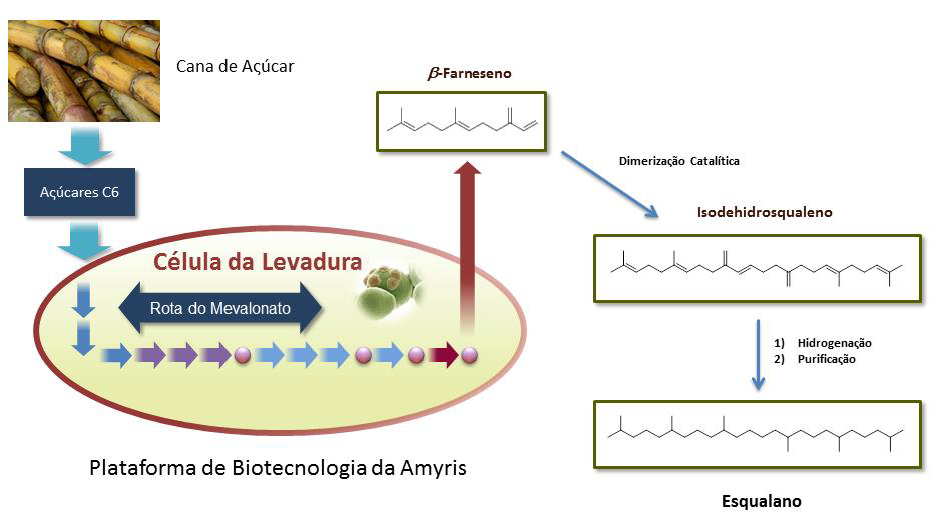
Finalmente, um novo processo foi desenvolvido com base na rota dos isoprenóides [34], permitindo a produção em escala comercial de esqualano a partir de recursos renováveis – açúcares fermentáveis. O betafarneseno, precursor biossintético natural do esqualeno, é produzido em escala industrial através de fermentação que utiliza leveduras comuns e não patogênicas Saccharomyces cerevisiae (“fermento de padeiro”). A levedura é então completamente removida, seguido por um processo químico simples que imita a forma natural de como é feito de esqualeno na Natureza. Dessa forma, associando esse processo inovador a tecnologias existentes de hidrogenação e de purificação, é possível então obter-se o esqualano de alta pureza, conforme demonstrado na Figura 2.
Figura 2. A biotecnologia utilizada para produção de esqualano a partir de açúcares fermentáveis.
Nossa primeira unidade de produção industrial de beta-farneseno iniciou suas operações no Brasil em dezembro de 2012. A usina está localizada em Brotas, no estado de São Paulo, uma região de grande produção de cana-de-açúcar, ao lado da usina de bioenergia Paraíso de onde saem tubulações com o caldo da cana direto para planta da Amyris. O vapor e energia utilizados na planta são provenientes da co-geração da usina vizinha. A Amyris então converte os açúcares da cana em beta-farneseno, que então é transformado em produtos renováveis para nossos clientes, incluindo o esqualano. O Brasil é o maior produtor de cana de açúcar do mundo, apresentando condições favoráveis de clima e solo para o plantio de cana de açúcar, uma das plantas mais eficientes em fotossíntese em nosso planeta. A Amyris definiu a cana-de-açúcar brasileira como sua principal matéria-prima, pois é a fonte mais abundante de açúcares vegetais, com baixo custo e com relativa estabilidade dos preços, assim como devido à capacidade do setor sucroenergético brasileiro de atender aos padrões internacionais de sustentabilidade.
As vantagens deste processo de fabricação podem ser resumidas como se segue:
- O produto é renovável e de fonte vegetal (100% USDA certificado como produto de fonte renovável) e aprovado pelo
- O processo de fabricação consistente e replicável, assim como a disponibilidade de matéria prima no Brasil, garante uma produção confiável e sustentável de esqualano, com fornecimento confiável e preços estáveis.
- A composição do produto final consiste inteiramente de
- A utilização de um processo de fabricação rigidamente controlado garante que o esqualano de açúcar seja extremamente consistente de lote para lote, tanto do ponto de vista sensorial (odor, cor) quanto do aspecto químico, sendo um grande diferencial em comparação ao esqualano de outras fontes, que podem apresentar variações consideráveis de lote para lote devido a variação das matérias primas ou etapas de processamento.
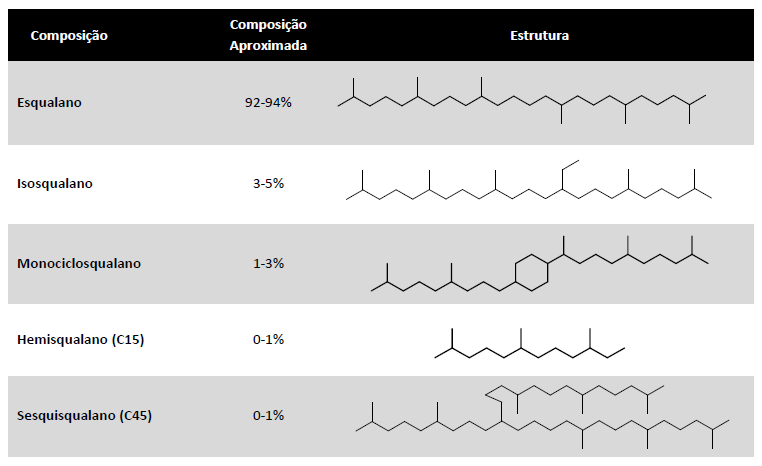
Uma vez que a matéria-prima do processo de fabricação é um hidrocarboneto de alta pureza, ao contrário do Esqualeno de fonte animal, que como mencionado acima, pode conter várias impurezas, é lógico esperar que os produtos e subprodutos deste novo processo sejam todos hidrocarbonetos também. A Tabela 2 mostra os principais produtos do processo e suas quantidades características. Como pode ser observado, o esqualano de cana de açúcar é composto de 99% de hidrocarbonetos de C30, o que lhe confere todas as características de alto desempenho encontradas no esqualano de fonte de tubarão, ou seja, odor, densidade, índice de refração e viscosidade, porém sendo um produto renovável e eco-friendly. Além disso, como o produto que entra para etapa de hidrogenação tem um elevado grau de pureza, é esperado um alto grau de saturação no esqualano resultante.
Tabela 2. Composição do Esqualano derivado de cana de açúcar.
Finalmente, em relação às variações de lote a lote, ao contrário dos outros produtos, o controle de processo extremamente rígido e a alta qualidade da matéria prima garantem pouca variabilidade do processo, como ilustrado na Figura 3, que mostra os dados de composição de 31 lotes consecutivos produzidos em 2013.
Figura 3. Variabilidade composicional de 31 lotes consecutivos de esqualano fabricados em 2013.
Conclusões
A história da produção de esqualano e consequente desenvolvimento e comercialização como um ingrediente cosmético foi significativamente afetada pela incerteza em torno da sustentabilidade e qualidade das fontes tradicionais, assim como seu processamento químico de alto custo e a falha das antigas tecnologias baseadas em fermentação. A biotecnologia moderna foi capaz de alavancar as reações enzimáticas catalíticas encontradas na natureza que foram então acopladas a etapas tradicionais de processamento químico para criar uma fonte de esqualano renovável e de alta qualidade. Este produto é produzido a partir de beta – farneseno, oriundo de um processo fermentação que utiliza a mesma levedura da indústria de alimentos. A partir de um processo químico projetado para produzir esqualano de uma maneira reprodutível, essencialmente inodoro, muito estável e com uma composição consistente de mais de 99% de hidrocarbonetos C30 de lote a lote. Como resultado, o esqualano de açúcar proporciona alta qualidade e um desempenho comparável ao do melhor produto comercial (esqualano de tubarão), porém feito de uma fonte renovável. Com este avanço na produção, esqualano renovável já está disponível para os formuladores de cosméticos e sem problemas de fornecimento ou volatilidade de preços.
Referências
- S-K Kim, F Karadeniz, Biological Importance and Applications of Squalene and In Advances in Food and Nutrition Research, Volume 65, S-K Kim, ed., Elsevier, Amsterdam, 2012, Chap. 14, 223- 233.
- Final Report on the Safety Assessment of Squalane and Squalene, Int J Toxicol, 1: 37-56, 1982.
- KR Smith, DM Thematic review series: skin lipids. Sebaceous gland lipids: friend or foe? J Lipid Res 49: 271-281, 2008.
- RS Greene, DT Downing, PE Pochi, JS Strauss, Anatomical variation in the amount and composition of human skin surface lipid, J Invest Dermatol 54: 240-247, 1970.
- T Nikkari, PH Schreibman, EH Ahrens, , In vivo studies of sterol and squalene secretion by human skin, J Lipid Res 15: 563-573, 1974.
- F Bouvier, A Rahier, B Camara, Biogenesis, molecular regulation and function of plant isoprenoids, Prog Lipid Res 44: 357-429, 2005.
- Para uma revisão recente, veja Spanova, G. Daum. Squalene – biochemistry, molecular biology, process biotechnology, and applications, Eur J Lipid Sci Technol 113: 1299-1320, 2011 e referências.
- Para entender como Michelet em 1913, Tsujimoto em 1916 e Chapman em 1917 reportaram o método de isolamento de um hidrocarboneto derivado de óleo de fígado de tubarão (embora o primeiro autor não o nomeou e Chapman o definiu como sendo seu óleo “spinacene”) e como essas três moléculas acabaram sendo reconhecidas como a mesma, veja Andre, H Canal, Contribition a l’étude des huiles d’animaux marins. I. Recherches sur le squaléne et la spinacéne, Ann Chim Appl 7: 69-112, 1927.
- M Tsujimoto, An unsaturated hydrocarbon in shark liver oil, J Chem Ind Jpn 19: 277-281 (1916).
- P Karrer, A Helfenstein, Synthesis of squalene, Helv Chim Acta 14: 78-85, 1931.
- S Sabetay, Perhydrosqualene, Revue Fran Corps Gras 3: 26-30, 1956.
- S Sabetay, Five years of perhydrosqualene‒a revolution in cosmetics, Riechstoff Arom 5: 274-276, 1955.
- T Nishida, Y Ninagawa, K Itoi, Y Fujita, New Industrial Synthesis of Squalane, Bull Chem Soc Jpn 56: 2805-2810, 1983.
- J Grossfeld, H Timm, A new characteristic for olive oil, Z Unters Lebensm 77: 249-253, 1939.
- MT Gapor, AR Hazrina, Squalene in oils and fats, Palm Oil Develop 32: 36-40, 2000.
- CA Auguet, A New Source of Squalane, Drug Cosmet Ind 82: 51-53, 1988.
- W Dickhart, The squalene contents of various oils, Am J Pharm 127: 359-361,1955.
- K Taufel, H Heinisch, W Heimann, The distribution of squalenes in vegetable fats, Biochem Z 303: 324-328,1940.
- Entre outros: a) ES540488 A1, Squalane and/or squalene by distillation of subproducts from physical refining and/or deodorization of vegetable oils, J Casanelles i Jene, assigned to Sociedad Union Derivan (Dec 1, 1985); b) ES555112 A1, Manufacture of squalene from olive oil refining wastes, T Traveria Casanova, assigned to Tadeval, S.A. (Jul 16, 1987); c) ES550683 A1, Manufacture of hexamethyltetracosenes and hexamethyltetracosanes from raw materials of plant origin, JM Vila Peris, M Alamany Goler, R Celades Colom, assigned to ITG Intergrup S. A. (Mar 1, 1987); d) ES2002428 A6, Preparation of 2,6,10,15,19,23-hexamethyltetracosane, i.e. squalane, by hydrogenating squalene in vegetable oils and fats, M Alemany Soler, R Celades Colom, assigned to Hispano Quimica S.A. (Aug 1, 1988).
- MM Storelli, E Ceci, A Storelli, GO Marcotrigiano, Polychlorinated biphenyl, heavy metal and methylmercury residues in hammerhead sharks: Contaminant status and assessment, Mar Pollut Bull 46: 1035-1039, 2003.
- A Gasparoli, C Mariani, MG Fedrigucci, Squalane: differentiation between vegetable and animal origin, Riv Ital Sostan Grasse 73: 293-302, 1996.
- Save Deep-sea Sharks: Squalene and Trade Restrictions. Deep Sea Conservation Coalition (DSCC), Save the Deep Sea website, available at http://savethedeepsea.blogspot.com/2011/08/save-deep- sea-sharks-squalene-and-trade.html (Accessed Dec 20, 2013)
- Matéria publicada por Oceana, 29 de Janeiro de 2008: Unilever to End Use of Shark Products in Cosmetics, Oceana Campaigns for Cosmetic Industry to Stop Using Shark Liver Oil, Oceana website, available at org/en/news-media/press-center/press-releases/unilever-to-end-use-of-shark- products-in-cosmetics (Accessed Dec 19, 2013).
- The Hideous Price Of Beauty: Cosmetics Industry Drives Deep-Sea Shark Extinctions, org website, available at www.bloomassociation.org/en/the-hideous-price-of-beauty (Accessed Dec 18, 2013).
- The Telegraph (UK), Hay Festival 2013: Supermodel Lily Cole: Ban cruel shark liver from make-up. The Telegraph website, available at telegraph.co.uk/culture/hay-festival/10090647/Hay- Festival-2013-Supermodel-Lily-Cole-Ban-cruel-shark-liver-from-make-up.html (Accessed Dec 18, 2013).
- A Gasparoli, C Mariani, ME Gaboardi, G Morchio, G Santus, About detection of animal squalene/ squalene in vegetable products used in the cosmetic field, Riv Ital Sostan Grasse 89: 4-28, 2012
- L Ruzicka, The isoprene rule and the biogenesis of terpenic compounds, Experientia 9: 357-67, 1953.
- KE Bloch, Nobel Lecture: The Biological Synthesis of Cholesterol, org. website, available at www.nobelprize.org/nobel_prizes/medicine/laureates/1964/bloch-lecture.html (Accessed Dec 19, 2013).
- US. Department of Commerce, National Institute of Standards and Technology, Advanced Technology Program. Performance of the Third 50 Completed ATP Projects, Status report – Number 4, NIST Special Publication 950-4. US Government Printing Office: Washington, DC, USA (September 2006) pp. 59-62. Available online at www.atp.nist.gov/eao/status_reports/chemistry_ and_materials_ edition/sp_950_4_complete.pdf (accessed Nov 15, 2013).
- Para exemplos, F Mantzouridou , MZ Tsimidou, Observations on squalene accumulation in Saccharomyces cerevisiae due to the manipulation of HMG2 and ERG6, FEMS Yeast Res 10: 699-707, 2010 and references therein.
- EP 2268823 A2, Production of squalene from hyper-producing yeasts, Broecker, assigned to Novartis AG (Jan 5, 2011).
- Para revisões sobre o tópico de contribuições da Amyris em particular veja: a) SS Chandran, JT Kealey, CD Reeves, Microbial production of isoprenoids, Process Biochem 46: 1703-1710, 2011; b) L Zhao, W Chang, Y Xiao, H Liu, P Liu, Methylerythritol Phosphate Pathway of Isoprenoid Biosynthesis, Ann Rev Biochem 82: 497-530, 2013.